Energieniveau
- Elektronenhülle oder Energieniveaus sind die angegebenen Abstände vom Kern eines Atoms, in denen Elektronen gefunden werden könnten, oder die höchste Wahrscheinlichkeit, gefunden zu werden. Elektronen sind negativ geladene Teilchen innerhalb eines Moleküls, die sich um den positiven Kern bewegen, normalerweise im Zentrum. Die Energieniveaus ähneln in etwa den Maßen der Elektronensprünge eines Schritts.
- In den meisten grundlegenden Konzepten eines Atoms; bestehen aus Elektronen, die um einen Kern kreisen.
- Die Elektronen sind jedoch nicht in der Lage, eine Umlaufbahn nach ihren Wünschen zu wählen. Elektronen sind auf Bahnen mit nur einem bestimmten Energieniveau beschränkt. Elektronen können nur von einem Energieniveau springen oder zu einem anderen springen. Elektronen können nicht mit anderen Energien als den angegebenen Energieniveaus umkreisen.
Was ist das Energieniveaudiagramm?
Energieniveau Mittel zur Bewertung der Menge an Energie, die Elektronen benötigen und die während des Übergangs freigesetzt werden, wenn sie von einer Umlaufbahn zur anderen springen. Der Grund- oder Nullzustand ist der für H berechnete minimale Energiezustand2 Moleküle.

Was sind die vier Energieniveaus?
Es gibt vier Arten von Orbitalen: p, d und f.
- Scharfes S
- Prinzip-p
- Diffus-d
- Grundlegend-f
In einem Atom gibt es einige Kombinationen davon Orbitale.
Das Energieniveau ist eine Menge von Raum oder Regionen, wo immer Elektronen wird wahrscheinlich anwesend sein. Diese als Orbitale bezeichneten Abstände haben unterschiedliche Formen und werden durch einen Buchstaben (s, p, d, f) bezeichnet.

Aussenseiter3, Atom-Orbital-Wolken spdf m0, CC BY-SA 4.0
Wie bestimmen Sie das Energieniveau?

BruceBlau, Blausen 0342 ElectronEnergyLevels, CC BY 3.0
Valenzelektronen
"Elektronen, die sich auf dem höchsten Energieniveau befinden, werden Valenzelektronen genannt."
Grundzustand
„Der minimale Energiegleichgewichtszustand des H.2 Atom wird als Grundzustand anerkannt. “
Aufgeregter Zustand
Wenn das Elektron (oder Atom) eine höhere Energie als diese niedrigste Energie hat, wird es als "angeregter Zustand" bezeichnet.
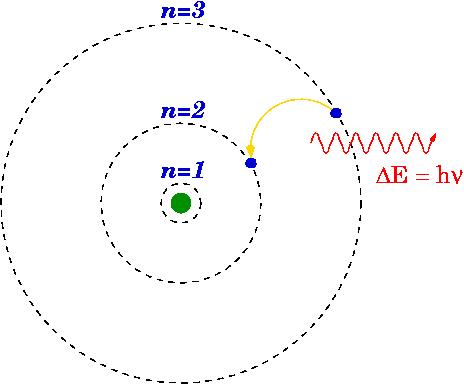
Wenn ein Elektron von einem höheren auf ein niedrigeres Niveau fällt, kann ein Photon emittieren oder Energie freigesetzt werden.
Energiedifferenz
Die Energie des emittierten Photons ist die Differenz zwischen den Energieniveaus des Primärs (n i ) und final (n f ) Zustand. Die Energie des emittierten Photons wird mit der Rydberg-Formel berechnet.
Das Bohr-Modell von Wasserstoff
1913 konzipierte Niels Bohr die Energieniveaus und die Spektralfrequenzn des H.2 bei der Betrachtung verschiedener einfacher Annahmen, um die hypothetische klassische zu fixieren. Die meisten dieser Mängel wurden durch Arnold Summerfields Modifikation des Bohr-Modells behoben. Für dieses Modell erhielt der Physiker Niels Bohr im Jahr 1922 den Nobelpreis für Physik.
In dem Grundkonzept, dass ein Atom (das Bohr-Atommodell), drehen Elektronen nur bestimmte Bahnen um den Kern. Die Elektronen, die zwischen erlaubten Bahnen hin und her gehen, kommen zusätzlich zur Emission oder Absorption von Energie vor.
Obwohl dieses Grundmodell nicht gut akzeptiert wird, weil der größte Teil der Struktur der Atome komplizierter ist als Wasserstoff, erfordert dies die neuen Subjekte, weshalb die Einführung der Quantenmechanik in der Quantenmechanik jedes umlaufende Elektron durch einen mathematischen Ausdruck erklärt wird, der als bekannt ist eine Wellenfunktion.
WeideW, Bohr-Atommodell, CC BY-SA 3.0
Bohrradius
„Der Bohr-Radius (a0) ist ein konstanter Parameter und entspricht dem vorhersagbarsten Abstand für das Wasserstoffatom zwischen dem Kern und dem Elektron im Grundzustand (nicht relativistisch und mit einem unendlich schweren Proton)."
Es ist nach Niels Bohr benannt, weil es Teil des Bohr-Modells eines Atoms ist.

SE3-29X, Wasserstoff GIF, CC BY-SA 4.0
Spektrallinien
Jede Komponente hat einen bestimmten Satz von Energieniveaus. Somit verhalten sich die Frequenzen, in denen es Licht absorbiert und emittiert, wie eine Art Mikrofon, das die spezifische Verbindung und bestimmte identifiziert. Diese Eigenschaften von Atomen wurden an Probanden untersucht, die als Spektroskopie bezeichnet werden. Diese Wissenschaft widmet sich der Identifizierung von Molekülen und Atomen anhand der Art der Strahlung, die sie absorbieren oder emittieren.
Balmer-Serie
Der Atomphysiker Balmer hat analytisch einen Zusammenhang in den Energien während der Freisetzung von Photonen aus dem Atom festgestellt. Die verschiedenen diskreten Photonenenergien / Wellenlängen, die von Balmer entdeckt wurden, werden als Balmer-Reihe bezeichnet.
Es war später bekannt, dass Energieübergänge die Balmer-Linien aus dem Wasserstoffatom erzeugen. Das Bohr-Modell des Atoms hat es geschafft, die Balmer-Reihe zu formulieren, da größere Umlaufbahnen Elektronen benötigten, um eine wesentlich höhere negative Leistung oder negative Energie zu haben, um sich mit dem Drehimpuls auszugleichen. Die Rydberg-Formel bietet einen umfassenden Überblick über die Balmer-Serie für alle Anpassungen des Energieniveaus.
Emissionsspektrum
Das Emissionsspektrum von atomarem Wasserstoff wurde in zahlreiche Spektralreihen und Wellenlängen unterteilt, die durch die Standard-Rydberg-Formel bereitgestellt wurden. Diese detektierten Spektrallinien sind das Ergebnis des Elektronenübergangs von verschiedenen Energieniveaus in einem Atom.
Ein Emissionsspektrum bezeichnet die Vielzahl von Wellenlängen, die von einem Atom oder einer chemischen Verbindung emittiert werden, die entweder durch Erhitzen oder elektrischen Strom stimuliert werden. Das Emissionsspektrum von brennendem Gas oder anderen Molekülen könnte auch verwendet werden, um seine Zusammensetzung zu bestimmen.
Bild-Kredit: Ranjithsiji, Atomemissionsspektrum von Helium, CC BY-SA 4.0
Potenzielle Energie
„Dies ist die Energie eines Unternehmens für seine Position relativ zu anderen Objekten, Spannungen, gespeicherter elektrischer Ladung oder anderen Faktoren in sich selbst. "
Bindungsenergie
"Die Bindungsenergie ist die minimale Energie, die erforderlich ist, um einen Kern zusammenzuhalten."
Ionisationsenergie
"Die Energiemenge, die ein isoliertes Atom im elektronischen Grundzustand absorbieren musste, um als e- “
Die Ionisierungsenergie wird als ein Schritt der Schwierigkeit beim Entfernen eines Elektrons in einem Atom oder Ion oder als die Fähigkeit eines Atoms oder Ions beschrieben, ein Elektron abzugeben. Das Nein der Elektronenreduktion findet normalerweise im Grundzustand der Spezies statt.
Die Ionisierungsenergien werden in kJ / mol oder der Energiemenge gemessen, die erforderlich ist, damit alle Atome in einem Mol die Einheit e bzw. lockern.
Wie funktioniert die Ionisierungsenergie?
Ionisierungsenergie ist die Energie, die benötigt wird, um ein isoliertes, gasförmiges Atom aus dem elektronischen Grundzustand zu absorbieren, um ein Elektron freizusetzen. Je mehr Elektronen verloren gehen, desto mehr + ve wird dieses Ion sein und es wird schwieriger sein, das e- vom Atom zu trennen.
Welches Element hat die höchste und niedrigste Ionisierungsenergie?
- Das Element He hat die höchste Ionisierungsenergie.
- Francium hat die minimale Ionisierungsenergie.
Die Ionisierungsenergie eines Elements wird im Periodensystem von links nach rechts höher und nimmt im Periodensystem im Allgemeinen von oben nach unten ab.
Cdang und Adrignola, Periodensystem der Ionisierungsenergie, CC BY-SA 3.0
Weitere Informationen zur Elektronenwolke Hier geht es weiter.
Lesen Sie auch:
- Ist potentielle Energie gespeicherte Energie
- Arten von kinetischer Energie
- Beispiel von elektrischer Energie zu Strahlungsenergie
- Beispiel von mechanischer zu elektrischer Energie
- Gravitationsenergie zu mechanischer Energie
- Windenergieformel
- Beeinflusst die Masse die potentielle Energie?
- Strahlungsenergie zu chemischer Energie
- Chemische Energie zu Schallenergie
- Beispiel für kinetische Energie in Schallenergie

Ich bin Subrata, Ph.D. in Ingenieurwissenschaften, insbesondere mit Interesse an Bereichen der Nuklear- und Energiewissenschaft. Ich verfüge über Erfahrungen in mehreren Bereichen, angefangen beim Servicetechniker für elektronische Antriebe und Mikrocontroller bis hin zu spezialisierten Forschungs- und Entwicklungsarbeiten. Ich habe an verschiedenen Projekten gearbeitet, darunter Kernspaltung, Fusion zu Solarphotovoltaik, Heizungsdesign und anderen Projekten. Ich interessiere mich sehr für die Bereiche Wissenschaft, Energie, Elektronik und Instrumentierung sowie industrielle Automatisierung, vor allem wegen der Vielzahl an spannenden Problemen, die diesem Bereich eigen sind und die sich jeden Tag mit der industriellen Nachfrage ändern. Unser Ziel ist es, diese unkonventionellen, komplexen Wissenschaftsthemen auf einfache und verständliche Weise auf den Punkt zu bringen.
