So finden Sie eine Redoxreaktion

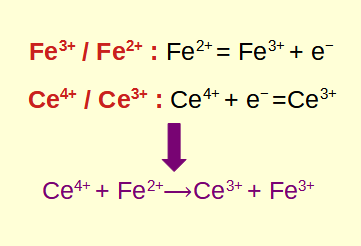

Redoxreaktionen, kurz für Oxidations-Reduktions-Reaktionen, sind grundlegende chemische Prozesse, bei denen Elektronen zwischen Reaktanten übertragen werden. Das Verständnis, wie Redoxreaktionen identifiziert und berechnet werden, ist in den Bereichen Chemie und Biologie von entscheidender Bedeutung. In diesem Blogbeitrag erforschen wir die Grundlagen von Redoxreaktionen, lernen, wie man sie identifiziert, vertiefen uns in die damit verbundenen Berechnungen und erkunden ihre praktischen Anwendungen.
Die Grundlagen von Redoxreaktionen verstehen
Redoxreaktionen treten auf, wenn Elektronen zwischen zwei Spezies übertragen werden. Eine Spezies verliert Elektronen (Oxidation), während die andere Spezies Elektronen gewinnt (Reduktion erfährt). Dieser Elektronentransfer wird durch einen Unterschied in der Elektronegativität der beteiligten Atome angetrieben.
Die oxidierte Spezies wird als Reduktionsmittel bezeichnet, weil sie Elektronen abgibt, während die reduzierte Spezies als Oxidationsmittel bezeichnet wird, weil sie Elektronen aufnimmt. Es ist wichtig zu beachten, dass Redoxreaktionen immer sowohl Oxidation als auch Reduktion beinhalten, daher der Name.
Bedeutung von Redoxreaktionen
Redoxreaktionen spielen bei verschiedenen chemischen und biologischen Prozessen eine entscheidende Rolle. Sie sind an der Energieerzeugung, Korrosion, Synthese von Chemikalien und sogar an der Funktion unseres eigenen Körpers beteiligt. Beispielsweise beruht der Prozess der oxidativen Phosphorylierung, der in den Mitochondrien unserer Zellen stattfindet, auf Redoxreaktionen, um ATP, die universelle Energiewährung der Zellen, zu produzieren.
Häufige Beispiele für Redoxreaktionen
Werfen wir einen Blick auf einige gängige Beispiele für Redoxreaktionen:
Verbrennung: Wenn ein Stoff mit Sauerstoff unter Erzeugung von Wärme und Licht reagiert, handelt es sich um eine Redoxreaktion. Zum Beispiel die Verbrennung von Holz oder die Verbrennung von Benzin in einem Automotor.
Rosten: Beim Rosten wird Eisen in Gegenwart von Sauerstoff und Wasser oxidiert. Das Eisen verliert Elektronen und es entsteht Eisen(III)-oxid (Rost).
Photosynthese: Bei der Photosynthese wandeln Pflanzen mithilfe von Sonnenlicht Kohlendioxid und Wasser in Glukose und Sauerstoff um. Dieser Prozess beinhaltet die Reduktion von Kohlendioxid und die Oxidation von Wasser.
Identifizierung von Redoxreaktionen
Um eine Redoxreaktion zu identifizieren, müssen wir die Substanzen erkennen, die einer Oxidation und Reduktion unterliegen. Hier sind einige wichtige Schritte, die uns helfen, Redoxreaktionen schnell zu identifizieren:
Oxidation und Reduktion erkennen: Achten Sie auf Änderungen der Oxidationsstufen oder den Verlust/Zuwachs von Elektronen. Wenn der Oxidationszustand eines Elements zunimmt, wird es oxidiert, während eine Abnahme des Oxidationszustands auf eine Reduktion hinweist.
Bestimmung der Oxidationszahl: Die Oxidationszahl ist ein Konzept zur Bestimmung der Elektronenverteilung in einer Verbindung oder einem Ion. Es hilft uns, die Änderung der Oxidationsstufen während einer Redoxreaktion zu identifizieren.
Redoxreaktionen schnell identifizieren: Eine wirksame Methode zur Identifizierung von Redoxreaktionen besteht darin, nach dem Vorhandensein bestimmter Elemente oder Verbindungen zu suchen, von denen bekannt ist, dass sie Redoxreaktionen eingehen. Beispielsweise ist Wasserstoffperoxid (H2O2) ein häufiges Oxidationsmittel, während Substanzen wie Natriumborhydrid (NaBH4) Reduktionsmittel sind.
Berechnung von Redoxreaktionen
Sobald wir eine Redoxreaktion identifiziert haben, können wir mit der Berechnung fortfahren. Hier ist wie:
Finden der Halbreaktionen: Teilen Sie die Redoxreaktion in zwei Halbreaktionen auf, von denen eine die Oxidation und die andere die Reduktion darstellt. Dies hilft später beim Ausbalancieren der Gleichung.
Ausgleich der Redoxreaktion: Gleichen Sie die Anzahl der Atome auf jeder Seite der Gleichung aus, indem Sie die Koeffizienten anpassen. Bei Redoxreaktionen ist es wichtig, sowohl Masse als auch Ladung auszugleichen.
Berechnung der gesamten Redoxreaktion: Kombinieren Sie die ausgeglichenen Halbreaktionen und stellen Sie sicher, dass die Anzahl der bei der Reduktion gewonnenen Elektronen der Anzahl der bei der Oxidation verlorenen Elektronen entspricht.
Fortgeschrittene Konzepte in Redoxreaktionen
Um unser Verständnis von Redoxreaktionen zu vertiefen, untersuchen wir einige fortgeschrittene Konzepte:
Bestimmung der Spontaneität von Redoxreaktionen: Die Spontaneität einer Redoxreaktion kann mit dem Konzept des Redoxpotentials bestimmt werden. Wenn das Redoxpotential positiv ist, erfolgt die Reaktion spontan, was auf eine höhere Wahrscheinlichkeit hinweist, dass sie auftritt.
Ermitteln des Koeffizienten von Redoxreaktionen: Die Koeffizienten einer ausgeglichenen Redoxreaktion stellen die relative Anzahl der Mole jeder beteiligten Spezies dar. Diese Koeffizienten sind entscheidend für stöchiometrische Berechnungen.
Die Rolle von Elektronen bei Redoxreaktionen verstehen: Elektronen sind die Ladungsträger bei Redoxreaktionen. Sie wandern vom Reduktionsmittel zum Oxidationsmittel und erleichtern so die Energieübertragung.
Praktische Anwendungen von Redoxreaktionen
Redoxreaktionen haben praktische Anwendungen in verschiedenen Bereichen. Schauen wir uns einige Beispiele an:
Redoxreaktionen im Alltag: Der Prozess der Atmung in unserem Körper beruht auf Redoxreaktionen, um Glukose in Energie umzuwandeln. Darüber hinaus basieren die Batterien, die wir täglich verwenden, wie Alkalibatterien und Lithium-Ionen-Batterien, auf Redoxreaktionen.
Industrielle Anwendungen von Redoxreaktionen: Redoxreaktionen sind in industriellen Prozessen wie der Metallgewinnung, der Galvanisierung und der Abwasserbehandlung von entscheidender Bedeutung. Sie tragen dazu bei, schädliche Schadstoffe zu entfernen und in weniger giftige Stoffe umzuwandeln.
Redoxreaktionen in biologischen Systemen: Im menschlichen Körper sind Redoxreaktionen an verschiedenen biologischen Prozessen beteiligt, darunter Stoffwechsel, Entgiftung und Immunreaktionen. Übermäßige Redoxreaktionen können jedoch zu oxidativem Stress führen, der Zellen schädigen und zu Krankheiten beitragen kann.
Lesen Sie auch:
- Knoevenagel-Reaktion
- Beispiel für eine lichtabhängige Reaktion
- Endotherme Reaktion
- Nucleophile Substitutionsreaktion
- Beispiel einer Synthesereaktion
- Photochemische Reaktion
- Beispiel einer endergonischen Reaktion
- Beispiel für eine Reaktion erster Ordnung
- Beispiel für eine lichtunabhängige Reaktion
- Kolbe-Reaktion

Hallo,
Ich bin Aditi Ray, ein Chemie-KMU auf dieser Plattform. Ich habe meinen Abschluss in Chemie an der Universität von Kalkutta gemacht und einen weiteren Abschluss an der Techno India University mit Spezialisierung auf Anorganische Chemie. Ich freue mich sehr, Teil der Lambdageeks-Familie zu sein und möchte das Thema auf einfache Weise erklären.
Lassen Sie uns über LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202 in Kontakt treten
