In diesem Artikel, „Salpetersäure-Lewis-Struktur“, Verfahren zum Zeichnen von Lewis-Strukturen, werden einige Eigenschaften mit einigen detaillierten Erklärungen kurz diskutiert.
Salpetersäure ist im Grunde eine ionische Verbindung bestehend aus H+ und nein3- Ion. Stickstoff und Sauerstoff haben 7 bzw. 8 Elektronen. Unter diesen sind nur Valenzelektronen um die jeweiligen Atome herum gezeigt, und der Rest der Elektronen nimmt an der Bildung kovalenter Bindungen teil.
Der Hauptausblick dieses Artikels besteht darin, die unten gezeigte Lewis-Punktstruktur von Salpetersäure zu zeichnen und zu analysieren.
Was ist Lewis-Struktur?
Lewis-Struktur oder als Lewis-Punktstruktur bekannt, ist eine Art der Darstellung eines beliebigen Moleküls mit den Valenzschalenelektronen um die jeweilige Spezies und den mit den Atomen verbundenen Bindungen.
Lewis-Punktstruktur wurde zuerst nach dem Namen des bedeutenden Wissenschaftlers Gilbert benannt. N. Lewis. Diese stellte er erstmals vor Lewis-Struktur Konzept in seinem Artikel mit dem Titel „Das Atom und das Molekül“ im Jahr 1916.
Lewis-Struktur Dies hilft tatsächlich bei der Bestimmung der Struktur, der Anzahl der an der kovalenten Bindung oder Bildung beteiligten Elektronen sowie der Tatsache, dass die Elektronen als nicht gebundene Paare verbleiben. Diese sind alle in gezeigt Lewis-Struktur. Es bietet auch einen Ausweg, um die formale Ladung jedes Atoms in einer bestimmten Molekülart zu berechnen.
Prozess zum Zeichnen der Lewis-Struktur
Dabei sind einige Punkte zu beachten Zeichnen Sie die Lewis-Struktur die unten erklärt werden-
- Zunächst werden die Ordnungszahlen sowie die Anzahl der Valenzelektronen jeder Spezies berechnet.
- Anzahl der Elektronen zum Auffüllen des Oktetts oder der Elektronen, die zum Auffüllen der Valenzschale dieser Spezies benötigt werden, die für jedes Atom gezählt wird Zeichnen Sie die Lewis-Struktur.
- Die Anzahl der in diesem Molekül vorhandenen kovalenten oder ionischen Bindungen sollte ebenfalls bestimmt werden.
- Nach der Bestimmung der obigen Parameter werden Skelettstrukturen des Moleküls gezeichnet, die die Valenzschalenelektronen und die im Molekül vorhandenen Bindungen zeigen.

Darin oben Lewis-Struktur von Kohlendioxid sind die nicht gebundenen Elektronen des Sauerstoffs um die Sauerstoffatome herum dargestellt. Es hat insgesamt acht Elektronen und die Elektronenkonfiguration ist 1s2 2s2 2p4. Das gesamte Valenzelektron beträgt sechs. Von diesen sechs Elektronen nehmen zwei Elektronen an der Bildung kovalenter Bindungen mit Kohlenstoff teil. Der Rest der vier Elektronen wird als nicht gebundene Elektronen um jedes der beiden Sauerstoffatome gezeigt.
Kohlenstoff hat die Ordnungszahl sechs mit Elektronenkonfiguration 1s2 2s2 2p2. Somit hat es vier äußerste Schalenelektronen und alle Valenzelektronen werden verwendet, um die vier zu bilden kovalente Bindungen mit zwei Sauerstoffatomen. Es werden also keine Elektronen um Kohlenstoffatome herum gezeigt.
Salpetersäure-Lewis-Struktur
Salpetersäure, bekannt als aqua fortis (englisch für starkes Wasser), ist eine sehr starke anorganische Säure Molmasse 63.012 g/mol und Dichte 1.41 g/cm3. Das Lewis-Struktur Salpetersäure kann auch unter Verwendung der oben erläuterten Verfahren gezogen werden.

Salpetersäure enthält drei Arten von Atomen, Wasserstoff, Sauerstoff und Stickstoff. Sauerstoff und Stickstoff haben acht bzw. sechs Elektronen. Sauerstoff hat insgesamt sechs Elektronen in seiner äußersten Schale und Stickstoff hat fünf Elektronen in seiner äußersten Schale.
Sauerstoffatome werden jeweils als 1,2,3 bezeichnet. Unter diesen Elektronen bezeichnet Sauerstoff Nummer 1 seine vier Elektronen (unter 8 Valenzelektronen) in kovalenter Bindungsbildung mit Stickstoff und Wasserstoff. Ein ähnlicher Fall wird auch für Sauerstoff mit der Nummer 3 beobachtet. Aber ein anderes Szenario ist für Nummer 2, die als Sauerstoff bezeichnet wird. In diesem Sauerstoff werden sechs Elektronen als nicht gebunden um die Sauerstoffatome herum gezeigt und werden negativ.
Stickstoff hat fünf Elektronen in seiner Valenzschale und verwendet seine vier dieser fünf äußersten Schalenelektronen zur Bindungsbildung mit drei Sauerstoffatomen und wird zu +1.
Formale Ladungsberechnung von Salpetersäure
Die formale Ladung jedes Atoms in einer ganzen Molekülart kann mit der folgenden Formel berechnet werden:
- Formelle Ladung = Gesamtzahl der Valenzelektronen – Anzahl der Elektronen, die ungebunden bleiben – (Anzahl der an der Bindungsbildung beteiligten Elektronen/2)
- Formale Ladung auf Nummer 1 und Nummer 3 bezeichnet Sauerstoff = 6 – 4 – (4/2) = 0
- Formale Ladung der Zahl 2, bezeichnet als Sauerstoff = 6 – 6 – (2/2) = -1
- Formale Ladung auf Stickstoff = 5 – 0 – (8/2) = +1
- Formalladung auf Wasserstoff = 1 – 0 – (2/2) = 0
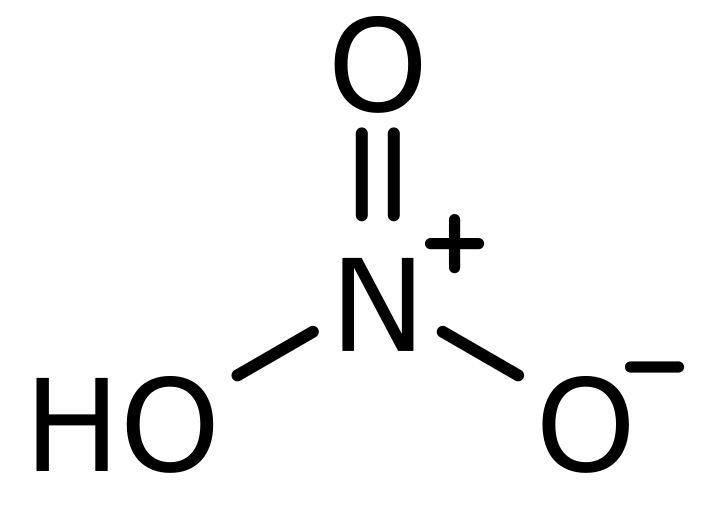
Bild-Kredit: Wikimedia Commons
Häufig gestellte Fragen (FAQ)
Reagiert Salpetersäure mit Wasser?
Antwort: Salpetersäure zersetzt sich zu Wasser, sie wird zu Stickstoffdioxid (NO2), Sauerstoff (O.2) und die resultierende Lösung wird gelblich.
Hno3 = NEIN2 + O2 + H2O
Reagiert Salpetersäure mit Metall?
Antwort: Salpetersäure reagiert mit Metall und setzt Wasserstoffgas frei (H2). Nach der Reaktion mit Salpetersäure bildet Magnesium (Mg) Magnesiumnitrat [Mg (NO3)2] und Wasserstoffgas.
Mg + HNO3 = Mg (NO3)2 + H2
Lesen Sie auch:
- Essigsäure-Lewis-Struktur
- Na2so4 Lewis-Struktur
- Seo2 Lewis-Struktur
- Hio3 Lewis-Struktur
- Hpo4 2 Lewis-Struktur
- Brcl5 Lewis-Struktur
- Mg2-Lewis-Struktur
- Keine Lewis-Struktur
- Nh2f-Lewis-Struktur
- Al3-Lewis-Struktur

Hallo,
Ich bin Aditi Ray, ein Chemie-KMU auf dieser Plattform. Ich habe meinen Abschluss in Chemie an der Universität von Kalkutta gemacht und einen weiteren Abschluss an der Techno India University mit Spezialisierung auf Anorganische Chemie. Ich freue mich sehr, Teil der Lambdageeks-Familie zu sein und möchte das Thema auf einfache Weise erklären.
Lassen Sie uns über LinkedIn-https://www.linkedin.com/in/aditi-ray-a7a946202 in Kontakt treten

Hallo Mitleser,
Wir sind ein kleines Team bei Techiescience, das hart mit den Großen zusammenarbeitet. Wenn Ihnen gefällt, was Sie sehen, teilen Sie unsere Inhalte bitte in den sozialen Medien. Ihre Unterstützung macht einen großen Unterschied. Danke schön!