Siliziumtetrafluorid (SiF4) hat ein zentrales Siliziumatom (Si) mit 4 Valenzelektronen, das Einfachbindungen mit vier Fluoratomen (F) bildet, die jeweils 7 Valenzelektronen beisteuern. Die Lewis-Struktur zeigt vier Si-F-Bindungen und keine freien Elektronenpaare auf Silizium, wobei 8 Bindungselektronen verwendet werden. SiF4 nimmt eine tetraedrische Geometrie mit Bindungswinkeln von etwa 109.5° an, was charakteristisch für die sp³-Hybridisierung ist. Das Molekül ist aufgrund seiner symmetrischen Form trotz der hohen Elektronegativität von Fluor (3.98) unpolar. Diese Struktur und die Stärke der Si-F-Bindungen haben erheblichen Einfluss auf die chemischen Eigenschaften von SiF4, einschließlich seiner Reaktivität und Rolle in der Halbleiterindustrie.

Lassen Sie uns den folgenden Punkt in diesem Artikel diskutieren
- wie man eine Lewis-Struktur für SIF4 zeichnet
- SIF4-Lewis-Struktur-Einzelpaare
- SIF4 Lewis-Strukturform
- SIF4 Lewis-Struktur-Oktett-Regel
- SIF4-Hybridisierung
- SIF4 Lewis-Struktur-Resonanz
- SIF4 polar oder unpolar
- Formale Gebühren für die Lewis-Struktur von SIF4
- SIF4 Lewis-Strukturform
wie man eine Lewis-Struktur für SIF4 zeichnet
Die Form eines Moleküls hängt von der Abstoßung zwischen dem Valenzelektronenbindungspaar oder dem nichtbindenden Paar ab. Im SIF4-Molekül sind die vier Fluoratome von einem zentralen Siliziumatom umgeben. Das Siliziumatom hat vier ungepaarte Elektronen,
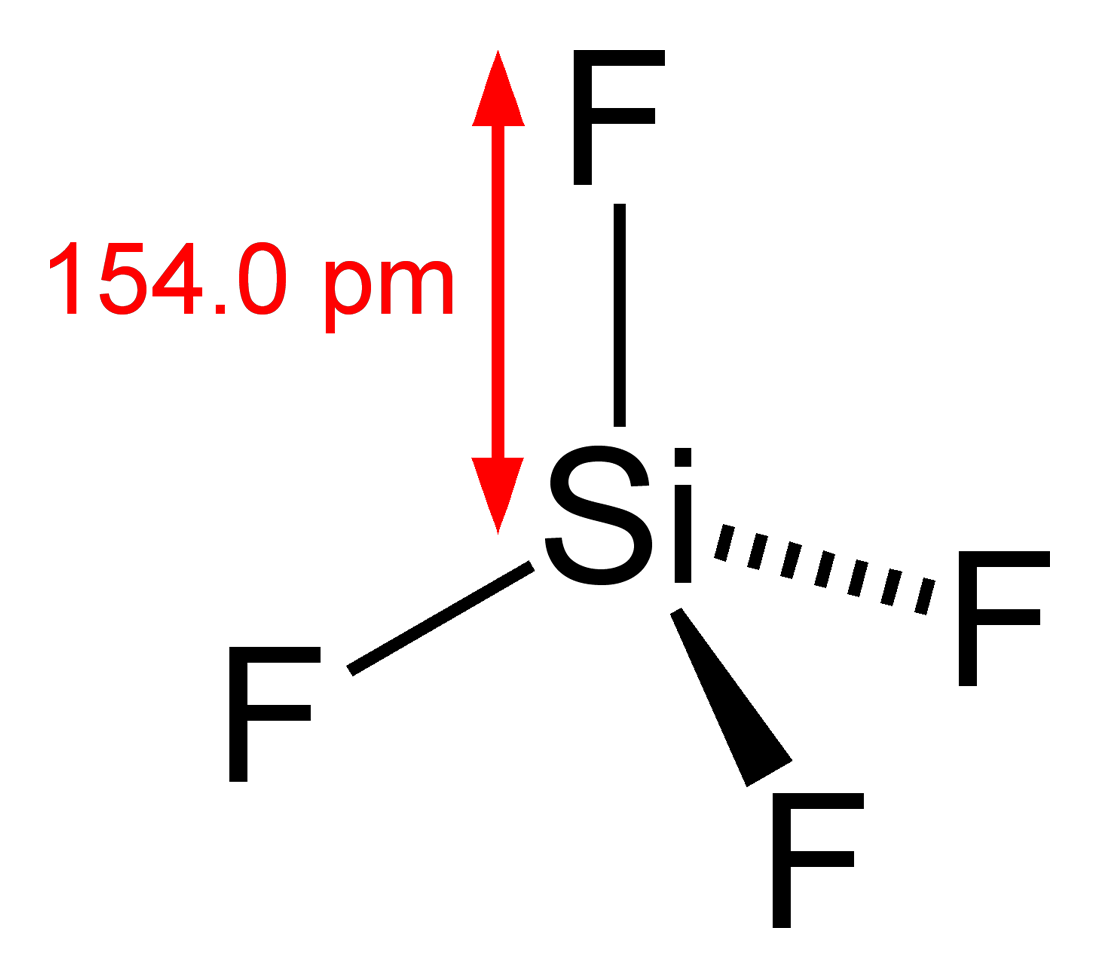
Gemäß der Oktettregel wird Silizium mit vier anderen Atomen gepaart, um sein Oktett zu vervollständigen. Daher bilden vier Si-F-Bindungen. Gemäß der VSEPR-Theorie weist das SiF4-Molekül eine tetraedrische Geometrie mit einem Bindungswinkel von 109.5 aufo und Bindungslänge von 154 pm.
SIF4-Lewis-Struktur-Einzelpaare
Valenzelektron eines Siliziumatoms = 4×1=4
Valenzelektron von vier Fluoratomen = 7×4=28
Valenzelektronen insgesamt = 32 es werden 16 Elektronenpaare für einen Stall benötigt Lewis-Struktur.
In der obigen Struktur haben wir insgesamt 16 Elektronenpaare mit vier Si-F-Bindungen, also bleiben 12 Elektronen übrig, die als freie Elektronenpaare bezeichnet werden, für jedes Fluoratom gibt es drei freie Elektronenpaare, daher sind insgesamt 12 freie Elektronenpaare um das Silizium herum vorhanden Atom,
und Silizium hat ein Null-Elektronenpaar, weil alle 12 Elektronenpaare um die vier Fluoratome herum vorhanden sind.
SIF4 Lewis-Strukturform

SIF4 Lewis-Struktur-Oktett-Regel
In obigem Lewis-Struktur, Silizium und Fluor haben keine Ladungen und das zentrale Siliziumatom vervollständigt sein Oktett, daher ist diese Struktur eine stabile Lewis-Struktur. Für eine stabile Lewis-Struktur müssen alle Atome in den vorhandenen Molekülen die Oktettregel erfüllen,
Die Oktettregel besagt, dass zum Erreichen einer stabilen Konfiguration die Valenzschale eines Atoms acht Elektronen enthält, die einer elektronischen Konfiguration des nächsten Edelgases ähneln.
Im SiF4-Molekül benötigt das Fluoratom nur ein Elektron, um sein Oktett zu vervollständigen, während das Siliziumatom vier Elektronen benötigt, um sein Oktett zu vervollständigen und stabil zu werden. Silizium- und Fluoratom teilen sich ein Elektron und vervollständigen ihr Oktett, Wasserstoff hat zwei Valenzelektronen und Silizium hat acht Valenzelektronen. Auf diese Weise vervollständigen sie ihr Oktett.
SIF4-Hybridisierung
Hybridisierung ist ein Prozess, bei dem die Atomorbitale beider Atome in einem Molekül zusammenkommen und sich miteinander verbinden, um ein Hybridorbital zu bilden, indem eine direkte überlappende Sigma-Bindung gebildet wird, während Parallelen von Seite zu Seite überlappen und eine Pi-Bindung bilden.
Im SiH4-Molekül ist die elektronische Konfiguration von Silizium:
Si: 1s2 2s2 2p6 3s2 3p2
Si: [Ar] 3s2 3p2

Aus dem obigen Diagramm kommen das s-Orbital und die drei p-Orbitale zusammen und verbinden sich zu 4 hybridisierten 3p3 Orbitale Diese 4 Hybridorbitale bilden vier Sigma-Bindungen mit vier Wasserstoffatomen. Daher ist die Hybridisierung für Si sp3 in SiH4.
SIF4 Lewis-Struktur-Resonanz
Resonanz ist ein chemisches Phänomen, bei dem sich die gesamten Eigenschaften eines Moleküls nicht mit einer einzigen Struktur erklären lassen. Es sind viele kanonische Strukturen beteiligt. Aber nicht jedes Molekül kann Resonanz zeigen.
SiF4 Lewis-Struktur zeigt keine Resonanz, da es keine Delokalisierung von Elektronen gibt und es das Vorhandensein von Einfachbindungen gibt. Es gibt also keine Bewegung. Obwohl einsame Elektronenpaare vorhanden sind, stört die Delokalisierung den Stabilitätsfaktor. Daher gibt es keine Resonanz Strukturen der SiFl4-Lewis Struktur
SIF4 polar oder unpolar
Die vier Fluoratome sind im SiF4-Molekül von einem zentralen Siliziumatom umgeben, die Elektronegativität des Siliziumatoms beträgt 1.90 und die Elektronegativität des Fluoratoms beträgt 3.98, die Differenz zwischen der Elektronegativität von Fluor und Silizium beträgt 2.08.
Dieser große Elektronegativitätsunterschied zwischen Silizium und Fluor weist darauf hin, dass die Elektronenpaare stark vom Fluoratom angezogen werden, weshalb die Si-F-Bindung im SiF4-Molekül polar ist. Der größere Elektronegativitätsunterschied zwischen ihnen weist darauf hin, dass das Elektronenpaar stark vom Fluoratom angezogen wird, weshalb die Si-F-Bindung stark polar ist.
Formale Gebühren für die Lewis-Struktur von SIF4
Im Siliziumtetrafluorid-Molekül entspricht die Anzahl der tatsächlichen Ladungen den gesamten formalen Ladungen. Die Formalgebühren werden vom SiF4 berechnet Lewis-Punktstruktur. Die nach folgender Formel berechnet werden,
Die formale Ladung am Si-Atom des SiF4-Moleküls = Valenzelektron des Silonpaars des Siliziums -1/2 (Bindungselektronenpaar)
Gemäß der formalen Ladungsberechnungsformel hat das Siliziumatom 4 Valenzelektronen, 4 Bindungselektronen und kein freies Elektronenpaar. daher , Im SiF4-Molekül Daher formale Ladung am Siliziumatom des SiF4-Moleküls = (0- 8-(2/0)) = XNUMX
Daher sind die Formalladungen im SiF4-Molekül Null.
SIF4 Lewis-Strukturform
Tetraederstruktur von SiF4 Unten gezeigt:
Häufig gestellte Fragen
Was ist die Lewis-Struktur von SiF4?
Antwort: Im Lewis-Struktur des SiF4-Moleküls ist das zentrale Siliziumatom von vier Fluoratomen umgeben, es bildet vier Si-F-Bindungen, alle Fluoratome haben jeweils drei freie Elektronenpaare.
Was sind die Ähnlichkeiten und Unterschiede zwischen den Lewis-Strukturen von XeO3 und SIF4?
Das xeo3 Lewis-Struktur erklärt zeigt, dass sowohl XeO3 als auch SiF4 Zentralatome haben, die von Elektronenpaaren und Bindungspaaren umgeben sind. Der wesentliche Unterschied liegt jedoch in der Anzahl der Elektronenpaare und Bindungswinkel. XeO3 hat 3 Bindungspaare und 2 freie Paare, was zu einer trigonalen Pyramidenform mit Bindungswinkeln von etwa 109.5° führt. Andererseits hat SiF4 4 Bindungspaare und keine freien Elektronenpaare, was ihm eine tetraedrische Form mit Bindungswinkeln von 109.5° verleiht.
Wie sagt man die Form von SiF4 voraus?
Antwort: Die Form von SiF4 wird durch die VSEPR-Theorie vorhergesagt. Das zentrale Siliziumatom hat vier Valenzelektronen, daher ist es mit vier Fluoratomen verbunden und bildet eine tetraedrische Geometrie.
Welche Bedeutung hat die Lewis-Struktur?
Antwort: Es definiert die Art der Bindung und die Position der Atome des Moleküls, die im Molekül verbunden sind. Die Darstellung von Molekülen in Lewis-Elektronenpunktstruktur oder nur einer Lewis-Struktur ist eine Ehre des amerikanischen Chemikers Gilbert Newton Lewis.
Lesen Sie auch:
- Ncl2-Lewis-Struktur
- CO2-Lewis-Struktur
- Bao Lewis-Struktur
- Sncl2-Lewis-Struktur
- H2so4 Lewis-Struktur
- Xecl2-Lewis-Struktur
- Chf3 Lewis-Struktur
- Na2so4 Lewis-Struktur
- Bf3 Lewis-Struktur
- H2o2 Lewis-Struktur

Hallo….ich bin Darshana Fendarkar, ich habe meinen Ph.D. abgeschlossen. von der Universität Nagpur. Mein Spezialgebiet ist Anorganische Chemie.
Ich habe Erfahrung als Chemiker bei Earthcare Pvt. Ltd. Außerdem verfüge ich über 2 Jahre Erfahrung im Unterrichten. Derzeit arbeite ich mit Lambdageek als Fachexperte zusammen.


Hallo Mitleser,
Wir sind ein kleines Team bei Techiescience, das hart mit den Großen zusammenarbeitet. Wenn Ihnen gefällt, was Sie sehen, teilen Sie unsere Inhalte bitte in den sozialen Medien. Ihre Unterstützung macht einen großen Unterschied. Danke schön!